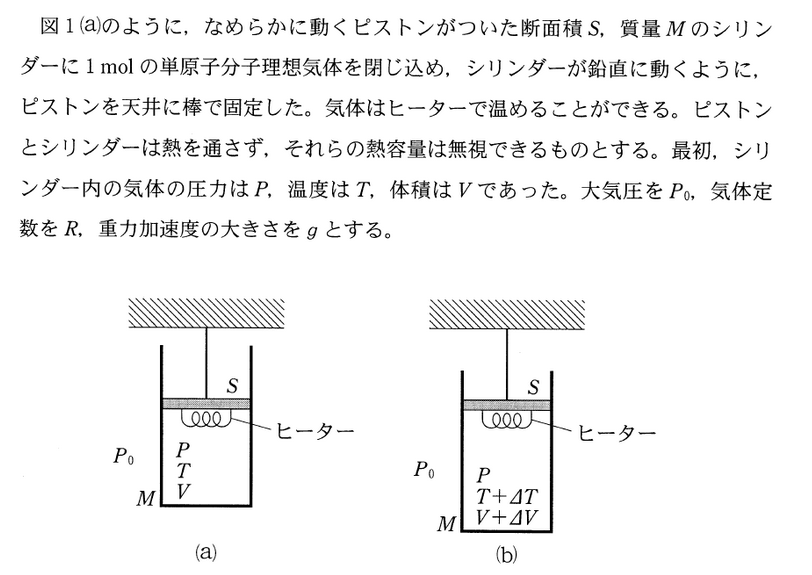
1. シリンダーが (a) の状態で静止しているとき,\(P\) を \(P_0, M, g, S\) の関数として表せ
下向きの力の一つとして
\[
\text{質量} \times \text{加速度} = \text{力}
\]
よって, \(Mg\) という力が下向きに働いています. また,シリンダー内部の圧力 \(P\) も下向きの力として働くので
\[
\text{下向きの力} = S\times P + Mg
\]
上向きの力として,\(P_0\times S\) があり,初期状態では静止している = 上向きと下向きの力が均衡しているので
\[
S\times P + Mg = S\times P_0
\]
したがって,
\[
P = P_0 = \frac{Mg}{S}
\]
2. シリンダー内の気体を温めると,シリンダーはゆっくり下降し,(b) の状態で静止した.このとき,体積の変化 \(\Delta V\) と 内部エネルギー \(\Delta U\) は \(\Delta T\) の関数としてどのように表せるか?
単原子分子理想気体では内部エネルギーは
\[
U = \frac{3}{2}RT
\]
したがって
\[
\Delta U = \frac{3}{2}R\Delta T
\]
また,状態変化後も圧力は \(P\) で同じなので,理想気体の状態方程式より
\[
\frac{V}{T} = \frac{V + \Delta V}{T + \Delta T}
\]
したがって,
\[
\Delta V = \frac{V}{T}\Delta T
\]